新型冠状病毒肺炎(COVID-19)的暴发已经在全球范围内引发了严重的公共卫生危机。SARS-CoV-2是导致COVID-19的主要病原体,它是继SARS-CoV和MERS-CoV之后第三种对人类具有高致病性的冠状病毒[1]。研究表明,ACE2(血管紧张素转化酶2)是介导SARS-CoV-2入胞的高亲和力受体,SARS-CoV-2通过其表面刺突蛋白(Spike,S)的受体结合域(RBD)与ACE2互作而感染细胞。然而,ACE2在人体器官中的表达分布与SARS-CoV-2的器官嗜性并不完全相关。比如,在整个呼吸道、大脑以及多种免疫细胞中,ACE2的表达较低或几乎不表达,但是这些细胞仍然可以被SARS-CoV-2感染。因此,可能存在ACE2以外的受体来介导病毒进入宿主细胞。
目前,已有多项研究发现与SARS-CoV-2感染相关的关键宿主因子,比如基于CRISPR基因敲除系统的高通量功能性筛选。然而,这些筛选均没有发现ACE2以外的新受体,这可能是因为此类基于功能缺失的筛选是在ACE2的表达和功能占主导地位的细胞类型中进行的[2-5]。
北京大学魏文胜课题组、中国医学科学院/北京协和医学院王健伟课题组与北京大学肖俊宇课题组在 Science China Life Sciences 杂志联合发表了题为“Genome-wide CRISPR activation screen identifies candidate receptors for SARS-CoV-2 entry”的研究论文,该研究通过基于CRISPR激活(CRISPR activation, CRISPRa)系统的全基因组水平的功能获得性筛选,发现了多个介导SARS-CoV-2入侵细胞的潜在新受体。
为了系统性研究SARS-CoV-2入胞的关键因子,该研究使用SARS-CoV-2假病毒在HEK293T细胞中进行了全基因组CRISPRa筛选。该筛选基于实验室之前建立的内置分子条形码(iBAR)方法[6]在sgRNA中添加外置条形码(eBAR),建立sgRNAeBAR文库,从而可以使用高感染复数及较少的细胞量进行高质量文库构建。筛选结果表明,除了发现已知的SARS-CoV-2受体ACE2、主要宿主细胞蛋白酶TMPRSS2以及已报道的ACE2依赖性共受体NRP1外,还鉴定出多种新型宿主因子可能参与SARS-CoV-2入胞机制中(图1)。
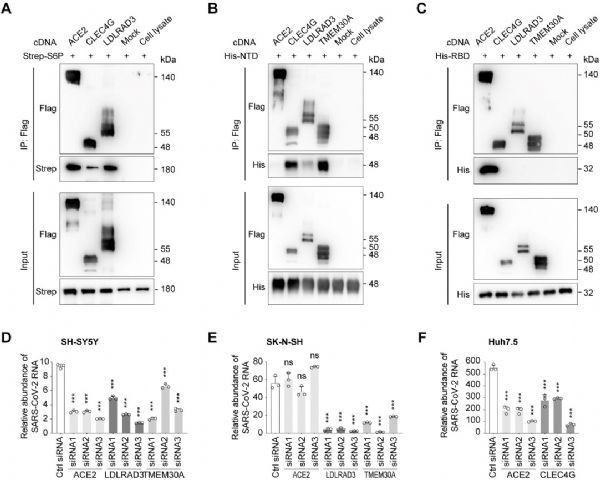
结合SARS-CoV-2假病毒和真病毒实验,该研究发现膜蛋白LDLRAD3、TMEM30A和CLEC4G能够以不依赖于ACE2的方式有效介导病毒入侵细胞。此外,研究证实这些膜蛋白都能够与SARS-CoV-2 S蛋白结合。与ACE2结合S蛋白的RBD不同,这些蛋白能够特异性结合S蛋白的N末端结构域(NTD)(图2)。LDLRAD3在神经元中高度表达,最近作为委内瑞拉马脑炎病毒(VEEV)的关键受体受到关注。实验表明,敲低LDLRAD3或在细胞上清中加入其可溶性蛋白可显着降低SARS-CoV-2对神经元细胞的感染。CLEC4G在肝脏、淋巴结和单核细胞中高度表达,已知其作为细胞粘附因子促进SARS-CoV感染宿主;通过在肝脏细胞中进行敲低实验证实了CLEC4G在SARS-CoV-2入侵细胞中的重要作用。跨膜蛋白TMEM30A在最近的SARS-CoV-2全基因组敲除筛选(Huh7.5细胞)中也被鉴定出来[4],研究进一步证实了其对于SARS-CoV-2入胞的重要性以及其与S蛋白的直接结合。这些具有组织特异性或广谱表达的新受体的发现,有助于进一步揭示SARS-CoV-2的多器官嗜性,并为探究COVID-19的新治疗靶点提供线索。(Bioon.com)