非酒精性脂肪肝(NAFLD),俗称脂肪肝,是一种在肥胖人群中经常出现的流行病。肝脏中的高脂肪含量是有害的,因为它与糖尿病、高血压和肝癌等严重健康问题密切相关。在一项新的研究中,中国香港大学生物科学学院助理教授Chi Bun Chan博士及其团队发现了一种新的防止NAFLD的保护机制。相关研究结果于2022年4月1日在线发表在Hepatology期刊上,论文标题为“Src homology 3 domain binding kinase 1 protects against hepatic steatosis and insulin resistance through the Nur77- fibroblast growth factor 21 pathway”。

肝脏是协调人体整体葡萄糖和脂肪代谢的重要器官。肝脏中的脂肪代谢紊乱将最终导致高血糖和高脂血症,这是患上糖尿病、高脂血症和肝癌的强大风险因素。据预测,NAFLD患者的数量将从2015年的8000万增加到2030年的1亿。虽然脂肪在肝脏中堆积的结果已得到充分证实,但仍不清楚肝脏是否拥有任何防御机制来对抗这种损伤。
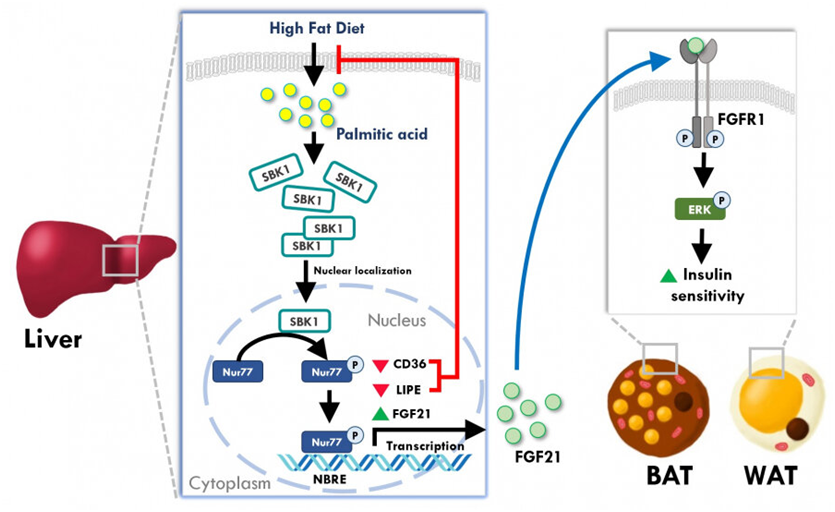
为了回答这个问题,Chan团队检查了高脂肪饮食诱导的肥胖小鼠肝脏中的基因表达,发现一种蛋白---SH3结构域结合激酶(SBK1)---仅在肥胖小鼠肝脏中升高。SBK1是2001年首次发现的一种蛋白激酶,但没有进行后续研究以确定它在哺乳动物中的功能。因此,这种新型蛋白的功能仍然未知。
Chan团队首次发现,脂肪酸的积累诱导小鼠肝脏中SBK1表达。他们还观察到,肝脏中缺乏SBK1基因的小鼠---称为“LSKO(liver-specific SBK1 knockout, 肝脏特异性SBK1基因敲除)”小鼠---在该组织中有更高的脂质积累和纤维化。此外,LSKO小鼠显示出不受控制的肝脏葡萄糖输出和更高的血糖水平,并且对胰岛素刺激的敏感性低于对照组,这些都是糖尿病产生的有力指标。
Chan团队发现SBK1蛋白是防止过度脂质积累的保护因子。图片来自Maris S.Y. Chan and Dr Palak Ahuja。
除了动物研究外,Chan团队还利用体外培养的细胞模型来回答SBK1基因如何控制肝脏中的脂质代谢的问题。他们发现SBK1会使Nur77磷酸化并增它的活性,其中Nur77是肝细胞中公认的转录因子,用于控制脂肪酸摄取和脂质合成。当肝细胞中的SBK1蛋白活性受到破坏时,它们摄取了更多的脂肪酸,并出现了过度的脂质积累,干扰了胰岛素信号传递。令人惊讶的是,当SBK1蛋白在体外培养的肝细胞和LSKO小鼠中被剔除时,肝细胞中的另一种代谢激素---成纤维细胞生长因子21(FGF21)---也下降了。鉴于FGF21是来自肝脏与其他外周器官(比如白色脂肪组织)沟通的重要激素,因此LSKO小鼠肝脏中FGF21激素分泌的减少损害了肝脏与其他器官的沟通,导致其他组织出现胰岛素抵抗。
为了将他们的研究结果推广到治疗方面,Chan团队进一步测试了操纵肝脏中的SBK1蛋白活性是否能挽救肥胖的破坏性影响。利用腺病毒介导的基因递送,他们在果糖饮食诱导的脂肪肝小鼠肝脏中短暂地增加了SBK1蛋白的数量,发现肝脏脂肪变性、炎症、高脂血症和高血糖等病理症状都得到了缓解。
Chan博士说,“我们的研究结果清楚地表明,SBK1蛋白是脂质代谢的一个重要调节因子,而这一点以前被忽视了。我们非常兴奋地看到,增加它的活性可以有效地缓解脂肪肝引起的健康问题。但我们仍然需要更多的研究来充分描述它的功能活性,以便我们能够开发SBK1激活剂作为这种常见肝病的新型治疗剂。”(生物谷 Bioon.com)