在一项新的研究中,来自韦尔科姆基金会桑格研究所、剑桥干细胞研究所和欧洲分子生物学实验室(EMBL)旗下欧洲生物信息学研究所(EMBL-EBI)的研究人员发现了基因突变如何在生命的不同时期劫持血细胞的产生。他们展示了这些变化与衰老和与年龄有关的疾病(包括血癌)的产生有何关系。这项新的研究代表着首次探讨了基因突变对细胞生长动态的终身影响。相关研究结果于2022年6月1日在线发表在Nature期刊上,论文标题为“The longitudinal dynamics and natural history of clonal haematopoiesis”。

所有人类细胞在一生中都会获得其DNA的遗传变化,即所谓的体细胞突变,其中一个特定的突变子集会驱动细胞增殖。这在造血干细胞中很常见,并导致具有相同突变的细胞群体(称为克隆)的生长。这种称为克隆性造血(clonal hematopoiesis)的过程随着年龄的增长而变得无处不在,并且是罹患血癌和其他年龄相关疾病的一个风险因素。
为了了解克隆性造血是如何和何时产生的,它是如何受到衰老的影响,以及它与疾病的关系,这些作者跟踪了385个55岁以上的人的近700个血细胞克隆,这些人是SardiNIA纵向研究的一部分。参与者定期捐献血液样品,时间长达16年。
对这些血液样本的DNA测序显示,在研究期间,92.4%的血细胞克隆以稳定的指数速度扩张。这种扩张速度主要受每个克隆中突变基因的性质的影响。
在捕捉到血细胞克隆在生命后期的行为后,这些作者使用数学模型来推断它们在整个人类寿命的生长模式。他们发现,随着年龄的增长,血细胞克隆的行为发生了巨大的变化,这取决于突变基因的身份。
首先,由DNMT3A基因突变驱动的血细胞克隆在年轻人中快速扩张,然后在老年时减速。其次,由TET2突变驱动的血细胞克隆出现并在整个生命过程中均匀增长,因此在75岁以后它们变得比携带DNMT3A突变的克隆更常见。最后,剪接基因(U2AF1和SRSF2)发生突变的克隆只在生命的后期扩展,并表现出一些最快的增长。
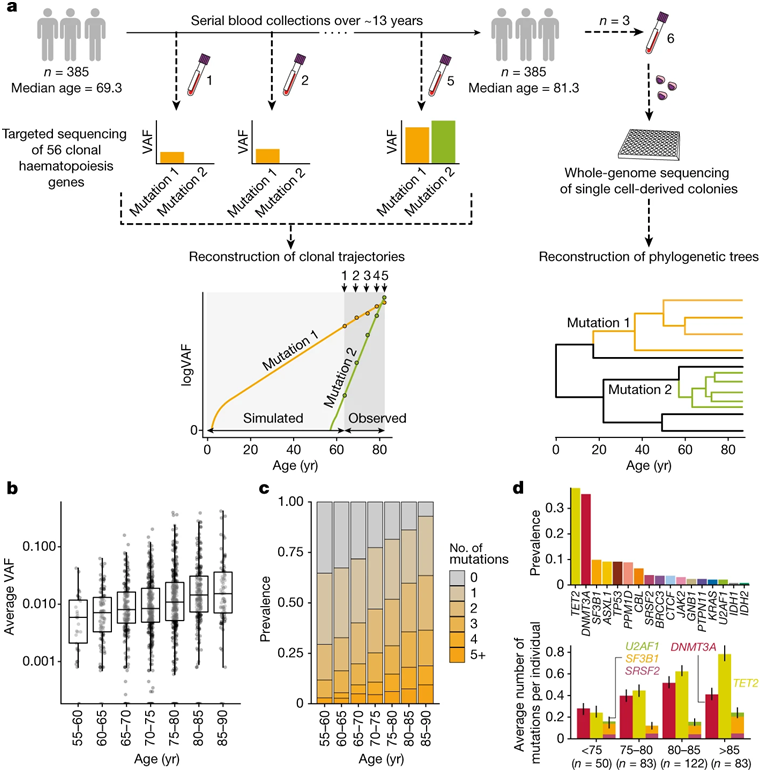
实验流程及克隆性造血突变特征。图片来自Nature, 2022, doi:10.1038/s41586-022-04785-z。
这些随年龄变化的克隆行为反映了不同类型血癌出现的频率,并揭示了与快速克隆生长相关的突变更有可能导致恶性肿瘤。
论文共同第一作者、韦尔科姆基金会桑格研究所博士生Margarete Fabre博士说,“我们的研究结果揭示了后天的基因变化如何在我们的一生中劫持血液形成,毕竟正常的造血干细胞与携带白血病前突变的造血干细胞在竞争。了解为什么一些突变在年轻时占上风,而另一些则在年老时占上风,可能帮助我们找到保持血细胞健康和多样性的方法。”
论文共同通讯作者、EMBL-EBI的Moritz Gerstung博士说,“我们首次能够使用基因组分析来了解我们血液中突变克隆(mutant clones)的过去、现在和未来。这些数据表明血细胞克隆的动态在几年内是惊人地可预测的,但也强调了它们在一生中以我们还不了解的方式变化。”
论文共同通讯作者、剑桥干细胞研究所血液学医学教授George Vassiliou说,“我们的研究总体上揭示了年龄增长和我们血细胞DNA突变之间的惊人互动,这种互动表现为不同年龄段携带不同突变的血细胞扩张。值得注意的是,这些变化导致在不同年龄段出现不同类型的血癌,并有不同的进展风险。有了这种新的认识,科学家们可以开始开发方法和治疗手段,以阻止血癌产生。”(生物谷 Bioon.com)