阿尔茨海默病(AD)领域又迎来了一个坏消息。
6月16日,罗氏和班纳阿尔茨海默病研究所共同宣布,靶向Aβ的单克隆抗体crenezumab在认知正常的常染色体显性AD患者中的预防性试验没有达到既定终点[1]。在继治疗早期AD的CREAD I和CREAD 2试验失利后,在NIH资助的这项研究中,crenezumab再次折戟,恐怕这次会成为这款药物的悲情谢幕。
在抗Aβ药物治疗中早期AD连番失利之后,科学界一个普遍的灵魂拷问是:我们是不是治得太晚了,如果在Aβ大量沉积之前就干掉它,结局会不会不一样?但crenezumab这次试验的结果无疑又让我们捡起了那个古老的灵魂追问:Aβ这个靶点到底行不行?在整个AD的病因链条上,Aβ究竟处在哪一级?
而近期,《自然·神经科学》的一篇重磅封面文章几乎以拨云见日的力度,给了我们意想不到的答案。
在这项研究中,科学家得到了几个重要发现[2]:
第一,此前在AD中发现的自噬障碍不是Aβ沉积的下游事件,而是上游事件,也就是说,先有自噬障碍,再有Aβ沉积;
第二,此前主流观点认为,Aβ沉积主要在神经元细胞外,但此次研究发现,在疾病早期,Aβ主要沉积在神经元细胞内;
第三,研究首次观测到,处于自噬应激压力下的神经元,呈现出绮丽的「毒花」景观,而最终在大脑中观测到的淀粉样老年斑,实则是这些「毒花」神经元死亡后的「遗骸」!
大家先平复一下心情,然后我们来详解一下这个研究。
这项研究的第一作者是美国内森·克莱恩研究所痴呆症研究中心的Ju-Hyun Lee,通讯作者是Ralph A. Nixon。两位在AD和自噬领域都做了大量的研究。

自噬和AD并不是首次牵手,两者之前的恩怨情仇其实由来已久。
以往已经有大量的研究显示,阿尔茨海默病中存在显著的自噬损伤,说明自噬和AD无论如何都是有一腿的。而来自罕见病的研究显示,损害自噬或溶酶体功能的突变可以在人类体内造成神经退行性疾病[2],说明自噬有直接导致神经退行性疾病的潜力。
虽然有一些蛛丝马迹,但自噬和AD在分子基础和病理学上究竟是什么关系,以往研究并没有搞清楚。不过主流观点认为,自噬障碍,是Aβ在神经元细胞外沉积的下游事件,是Aβ触发的一系列结果之一。大白话就是,Aβ是大魔王,自噬障碍不过是大魔王干的坏事儿之一。
而本次研究,则对这些传统认识发起了猛烈冲击。
要搞清楚自噬和AD啥关系,就需要有一个观测大脑中自噬过程的好方法。
为了监测AD病理中的自噬过程,研究团队开发了一种双荧光探针,同时动用了若干高端的成像方法。为了理解这个探针的工作原理,我们先来简单复习一下自噬的一些基础知识。(后面的研究方法搞不太懂也没有关系,可以直接穿越看结论)
我们知道,自噬在细胞体内发挥着类似“清道夫”的功能。具体实现方式分为三种类型:巨自噬、微自噬和分子伴侣介导的自噬。在巨自噬过程中,有几个关键步骤,双层膜形成自噬小泡→自噬小泡捕获需要降解的细胞器或蛋白质形成自噬体→自噬体与溶酶体结合→形成自噬溶酶体。在这个过程中,LC3蛋白会和自噬体结合,因此LC3蛋白也可以作为一种自噬的示踪剂。
荧光显微镜mRFP-eGFP-LC3融合蛋白示踪是研究自噬的常用方法。mRFP是稳定的荧光表达基团,显示红色;GFP是酸敏感型蛋白,显示绿色。
当自噬体和溶酶体未融合时,红绿两种荧光都显示,融合后是黄色。当自噬体和溶酶体融合后,如果溶酶体酸性环境正常,则GFP淬灭,仅显示红色;如果酸化不足,GFP不淬灭,显示黄色。
为了区分黄色荧光是溶酶体酸化不足,还是没有结合溶酶体,研究团队还对溶酶体进行了蓝色标记。两者未结合显示黄色,结合后酸化正常,红+蓝显示紫色,结合后酸化异常,红绿蓝融合显示白色。
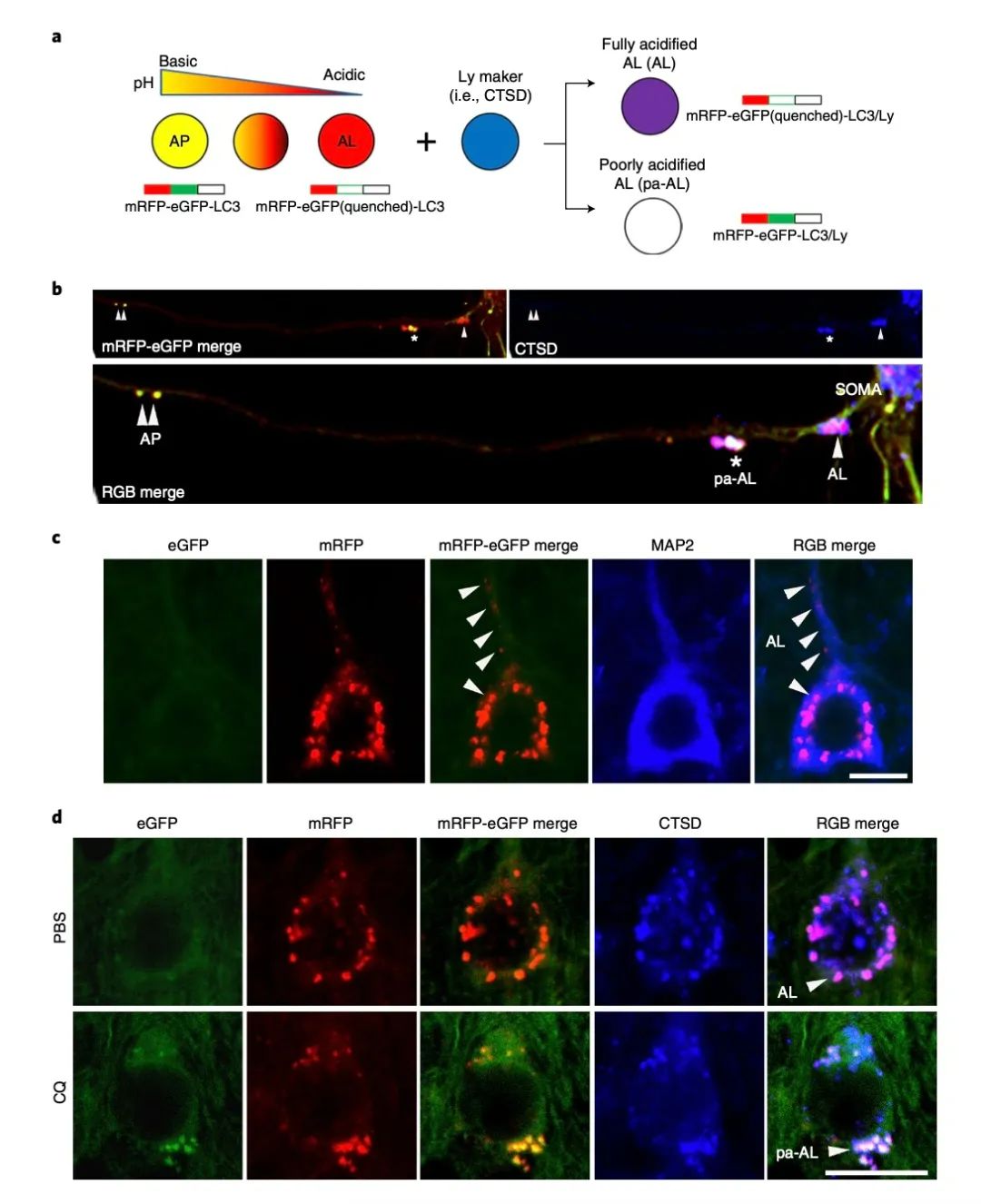
在这项研究中,研究人员培育了一种可以让mRFP-eGFP-LC3在神经元中特异性表达的TRGL小鼠,然后再将TRGL小鼠与AD模型小鼠Tg2576杂交,培育出可以监测自噬进程的AD小鼠模型。使用这个小鼠模型,研究团队得到了以下两个重要的发现。
?第一,在发展出Aβ斑块之前,小鼠的神经元中就已经出现了自噬障碍,而这种自噬障碍是溶酶体酸化不足造成的。在疾病早期,Aβ在酸化不足的自噬溶酶体内聚集。
研究观察到,小鼠5个月时,超过90%的新皮质III–V层核周体内,除了酸化的自噬溶酶体之外,还出现了酸化不足的自噬溶酶体(pa-AL),而且Tg2576/TRGL中pa-AL比TRGL小鼠多四倍。
要知道,Tg2576小鼠一般在10~12个月发展出Aβ斑块。这说明在Aβ斑块出现之前,AD模型小鼠神经元中就已经出现了因酸化不足导致的自噬障碍。
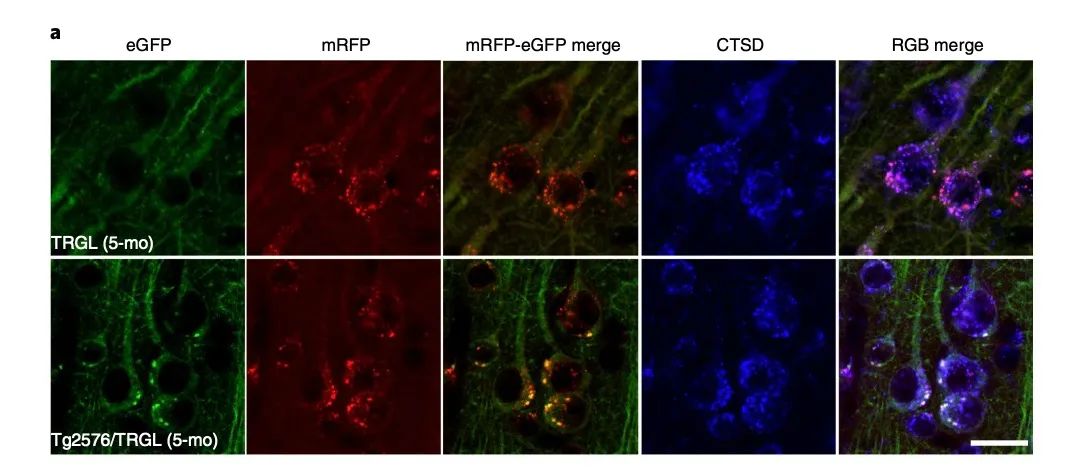
进一步,研究人员发现了自噬溶酶体酸化缺陷的原因:与野生型同窝仔小鼠相比,6个月大的AD小鼠溶酶体和自噬溶酶体中 vATP 酶活性降低,而vATP 酶是维持溶酶体酸性环境的关键。
除此之外,研究人员还发现,5个月时,Tg2576/TRGL小鼠中40%的III-V层新皮质周核含有Aβ/APP-βCTF阳性聚集点,基于 CTSD标记,这些聚集点几乎都在于pa-AL中。几种方法均验证,早期Aβ是在pa-AL内沉淀。也就是说,在疾病早期,Aβ是沉积在神经元内的。
?第二,在巨大的自噬应激压力下,大量Aβ阳性消化不良的自噬体聚集在神经元内形成了绮丽的「毒花」;而最终在大脑中观测到的淀粉样老年斑,实则是这些「毒花」神经元死亡后的「遗骸」!
随着疾病的进程,Aβ不断在pa-AL内沉淀。在10个月大的Tg2576/TRGL小鼠中,新皮层神经元亚群(III-V 层)开始积累显著增大的 pa-AL,并使质膜向外凸出。
大量含有Aβ的pa-AL在神经元周核聚集,形似花朵,形成了一种奇异的自噬应激形态,研究人员将其称为「毒花」(PANTHOS)!这也是科学家首次在AD模型中观测到这种形态。
那么,这些Aβ阳性的「毒花」是否为Aβ沉淀的主要形态呢?研究发现,在年轻的AD小鼠模型中,用Aβ抗体检测到的Aβ核心斑块,与显示在中央核的PANTHOS神经元几乎1:1重合。
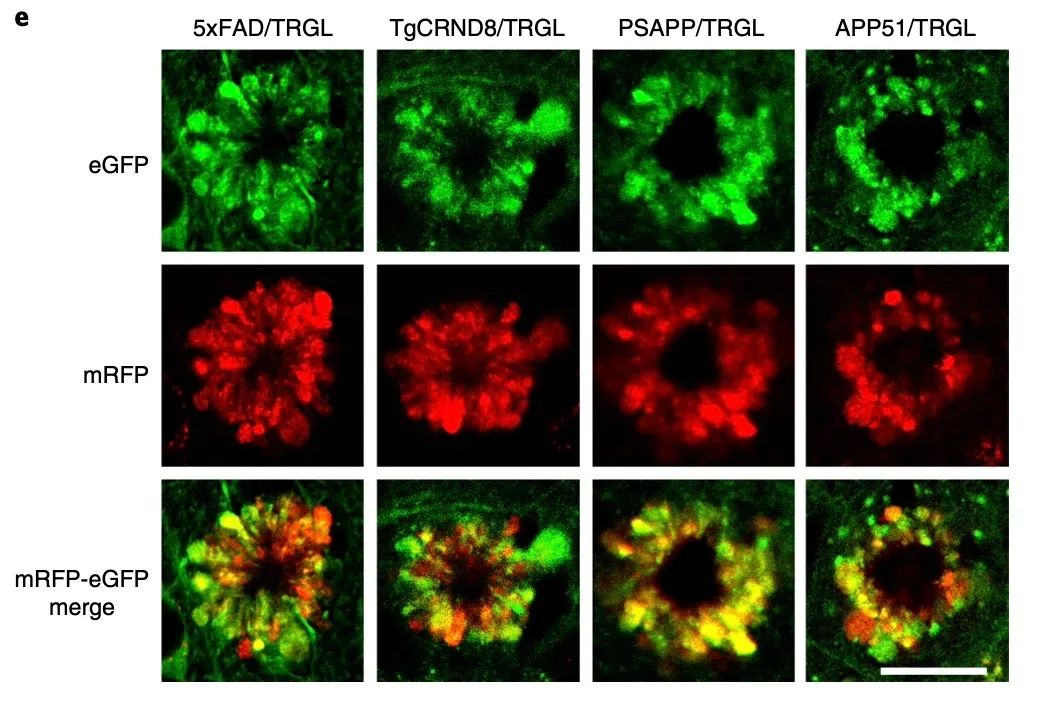
为了表征PANTHOS神经元向成熟斑块的演变,研究团队用硫黄素 S (Thio-S) 对PANTHOS进行免疫标记,以检测致密的老年斑块。在2.2个月大的模型小鼠定量分析中,一半的PANTHOS谱为Thio-S阳性,而在6个月大时, 超过95%为Thio-S阳性。
PANTHOS神经元具有免疫原性,会召集小胶质细胞或星形胶质细胞入侵神经元,导致神经元的死亡,将神经元内的淀粉样蛋白病变转变为细胞外淀粉样蛋白斑块。在小鼠6个月时,大量PANTHOS神经元表现出结构完整性的丧失,并被两种胶质细胞结合。除此之外,由于溶酶体碱化可促进溶酶体膜透化,将组织蛋白酶释放到细胞质中,促进神经元细胞死亡。
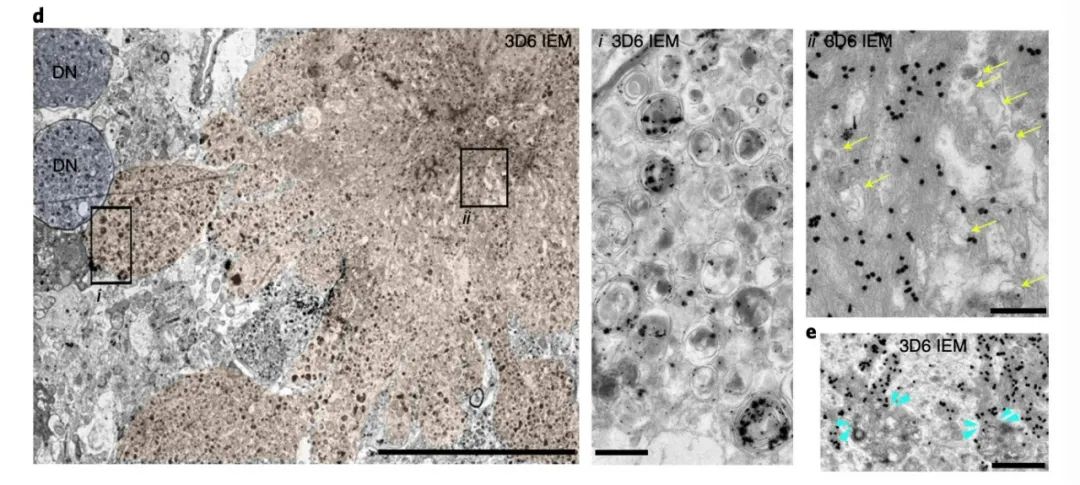
在较老的小鼠中,相邻的PANTHOS神经元合并成一个包含多个Thio-S阳性致密核心的单个较大斑块,随着病变的不断扩大,最终形成了细胞外致密核心老年斑。由此看来,在大脑中观测到的淀粉样老年斑,实则是这些「毒花」神经元死亡后的「遗骸」!
总结来看,这项研究首次发现,在AD病理中,神经元内自噬障碍先于Aβ沉积,是上游事件,而非传统意义上的下游事件。
疾病早期,Aβ就在存在自噬障碍的神经元内沉积;自噬障碍进一步触发了应激事件,消化不良的自噬溶酶体在神经元内围绕核周形成绮丽的「毒花」,并在胶质细胞和溶酶体碱化的推动着下,导致神经元死亡,「死亡残骸」就是老年斑。
整个这一过程极大颠覆了以往我们对老年斑形成过程的认知。
值得一提的是,研究团队发现,通过修复PSEN1相关的溶酶体酸性缺陷可以改善AD模型中的自噬障碍和其他与AD相关的病理。
最后再问一个细思恐极的问题。我们知道,在痴呆出现前的10~20年里,Aβ就开始沉积。现在我们又知道,自噬的酸化障碍要早于Aβ的沉积,那么AD的种子究竟是何时埋下的?