近期国内多省市的新冠疫情非常凶猛。
先是吉林“禁止跨省跨地区流动”,后是上海“全域静态管理”。
从上海市卫生健康委员会发布的数据来看,今年2月26日至5月6日,累计本土确诊55384例(阳性感染者总数超60万),在院治疗7699例(其中重型464例,危重型87例),死亡528例[1]。
在汇总死亡病例的特征的时候,我们发现几乎所有患者均合并有包括晚期恶性肿瘤、严重的心血管疾病、糖尿病、慢性肾脏病等严重的多脏器基础疾病,且病情危重。
这也提示,那些有进展为重症的感染者应该尽早开始抗病毒治疗。根据《新型冠状病毒肺炎诊疗方案(试行第九版)》[2],中和抗体组合安巴韦单抗/罗米司韦单抗和小分子药物Paxlovid被推荐用于轻型和普通型,且伴有进展为重型高风险因素的成人。
不过需要注意的是,第九版《诊疗方案》明确指出,使用Paxlovid前应详细阅读说明书,不得与哌替啶、雷诺嗪等高度依赖CYP3A进行清除,且其血浆浓度升高会导致严重和/或危及生命的不良反应的药物联用。实际上,合并重度肝肾功能不全(eGFR<30ml/min,或Child-pugh C级)的患者,也不推荐使用Paxlovid[3]。而不直接经过肝肾代谢的长效中和抗体安巴韦单抗/罗米司韦单抗则不存在这样的问题。
电镜下的新冠病毒(图源:NIAID-RML)
此外,虽然接种疫苗可以显著降低重症和死亡风险,但一些特殊群体因无法接种疫苗或对疫苗反应差而无法获得保护。例如,那些对疫苗成分过敏或者出现严重不良反应的患者,不适合接种疫苗;对于存在免疫抑制的患者而言(例如长期使用免疫抑制药物,器官移植,正在接受治疗的血液系统和实体肿瘤),他们对疫苗反应差,接种了疫苗后中和抗体滴度非常低,感染的风险仍然较高[4,5]。
因此上述脆弱人群无论感染还是发生重症的风险都更高,对于治疗疾病或是预防感染,长效中和抗体无疑都是目前较好的选择。
那么究竟什么是长效中和抗体?应用时为何可以不考虑肾脏功能,又为什么能同时发挥治疗及预防新冠感染的作用?要想从根本上了解这些问题,我们还得从抗体的结构,以及代谢方式说起。
抗体是人体免疫系统的重要组成部分,人类在1890年代才发现它的存在,直到1960年代科学家才知道只有淋巴细胞才能产生抗体[6]。
近半个世纪的科学研究成果告诉我们,人体内的抗体有IgA、IgD、IgE、IgG和IgM五大类。其中IgG类抗体占比最高,大约占血清中抗体总量的85%;浓度最大,高达9.5–12.5mg/mL;半衰期最长,平均为23天[7]。
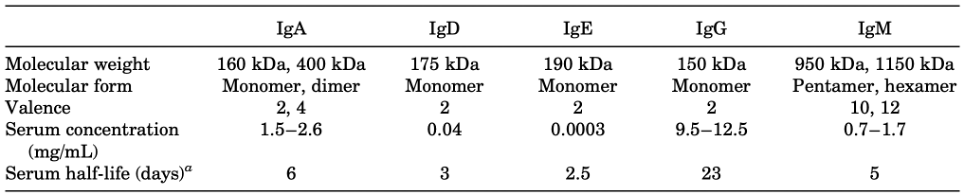
人体内五大类抗体的基本特征[7]
目前临床治疗用的抗体也主要是IgG类,治疗或预防新冠肺炎的中和抗体也都是IgG类抗体,因此后面的内容我们也主要围绕IgG类抗体展开。
从结构上看,IgG类抗体由4条多肽链组成,两条长的重链(h)和两条短的轻链(l),四条链在一起组成一个“Y”型结构。
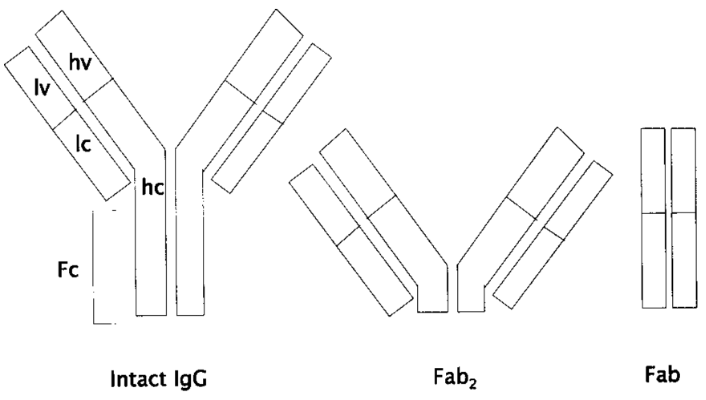
IgG类抗体结构示意图[7]
从功能上看,IgG抗体又可以分成两大部分:“Y”上半部分的两臂是抗原结合片段(Fab),负责识别结合抗原,例如结合新冠病毒S蛋白的就是中和抗体的Fab部分;“Y”下半部分是可结晶片段(Fc),这部分虽然不与抗原结合,但是介导多种生物学效应,而且与抗体的半衰期密切相关。
从分布上看,IgG是具有极性的大分子蛋白质,它们通过对流及受体介导的跨细胞转运两种方式由循环系统进入不同器官及组织[7]。有研究人员曾系统地分析了IgG抗体在不同组织的分布情况,他们发现,肺部IgG浓度相对较高,约为血浆浓度的14.9%,心脏这一数据约为10.2%,肾约为13.7%[8]。
从代谢上看,作为大分子蛋白,IgG的清除不需要肝细胞色素酶系统代谢,因此与相关药物无相互作用[9];IgG也不会经过肾脏滤过或分泌,而是主要是被组织内皮细胞或单核细胞摄取并分解清除[10]。
早在1960年代,Roger Brambell博士就提出了一种抗体代谢机制,他认为位于细胞区室和/或细胞表面上的受体可以保护IgG抗体,使其免于被分解代谢[11,12]。1989年,Neil E. Simister和Keith E. Mostov终于克隆到了保护IgG抗体的受体,它就是新生儿Fc受体(FcRn)[13]。
经过二三十年的研究,FcRn保护IgG抗体的机制已经基本明确。具体来说就是,血液中的IgG抗体会被内皮细胞或单核细胞摄取,进入细胞之后,IgG抗体在酸性(pH在6-6.5时)内体中与FcRn结合(毫摩尔或纳摩尔级的低亲和),免于被溶酶体降解;未与FcRn结合的IgG(由于其他IgG的竞争)将进入溶酶体降解;随后与FcRn结合的IgG抗体被转运到细胞表面,在那里遇到生理环境(pH在7.4左右),IgG抗体与FcRn分开,IgG抗体被重新释放到组织间液或血液中[14]。
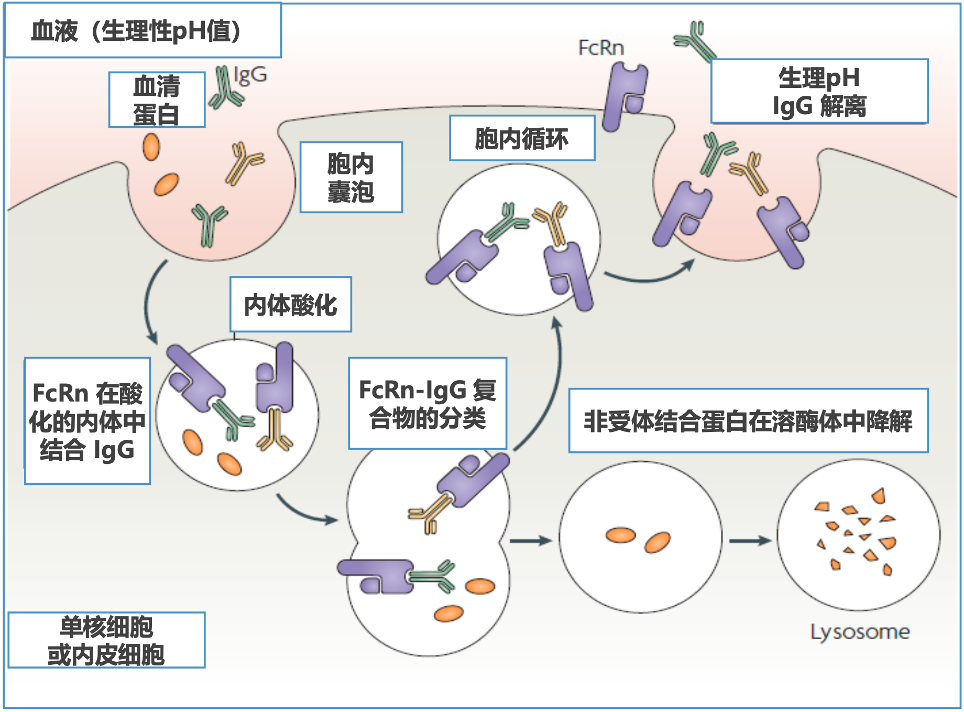
FcRn调节IgG代谢的机制[15]
从理论上讲,通过FcRn与IgG的结合,可以调节体内IgG的平衡:当IgG大量存在时,结合IgG的FcRn趋于饱和,不能与FcRn结合的IgG将被溶酶体降解,而当IgG浓度低时,IgG与FcRn结合得以保存[14,15]。这也是IgG抗体平均半衰期能长达23天的原因。已经有动物实验表明,FcRn缺陷会导致小鼠体内IgG的半衰期从6-8天缩短到1天[15]。
可以说表达FcRn的细胞其实就是IgG抗体水平的调节器。虽然IgG抗体的糖基化、电荷和等电点(pI)、靶点介导的药物处置(TMDD),以及抗药物抗体(ADA)等也会影响抗体的代谢,但是FcRn是最关键也是被研究的最多的IgG抗体代谢调节因子[14]。
近年来,科学家围绕IgG抗体的Fc段氨基酸序列做了大量的研究,试图找到影响IgG抗体与FcRn亲和力的关键氨基酸。
相关研究表明,IgG抗体Fc段的T250Q/M428L、V308P、M428L、M252Y/S254T/T256E(YTE)、M428L/N434S(LS)、N434A和N434H等多种突变,能在pH为6的情况下,提高改造后的IgG与FcRn的亲和力,同时保证了二者在生理pH条件下的分离不受影响。这些突变体的体内实验表明,它们可使食蟹猴和恒河猴体内改造后的治疗抗体的终末半衰期延长2-4倍[14]。
半衰期的延长意味着血药浓度能长时间维持在一个较高的水平,而血药浓度的持久稳定,也意味着靶器官肺部的中和抗体浓度也会长期维持在较高的水平,这对于疾病的治疗和预防都是非常有价值的。已经有研究表明,抗体半衰期的延长,会使它们的作用更持久[16-18]。
在上面提到的所有Fc突变类型中,YTE是研究的最多且使用最广泛的突变形式之一。例如,呼吸道合胞病毒(RSV)中和抗体Nirsevimab(MEDI8897)就经过了YTE改造。
临床前的研究表明,Nirsevimab的Fc段引入了YTE突变之后,与原始抗体相比,在食蟹猴体内的半衰期增加了3倍以上[19]。而两项临床研究表明,Nirsevimab在人体内的平均半衰期在60天左右[20,21],是普通IgG类抗体平均半衰期的3倍左右[7]。
最重要的是,Fc段经过YTE改造后的抗体能提供持久且有效的保护作用。例如,单次注射Nirsevimab就可将早产儿/足月儿出现就医的呼吸道合胞病毒感染风险降低70%以上,而且这种保护作用至少能持续150天[20,21]。
同样地,我国目前唯一获批的抗新冠病毒抗体组合安巴韦单抗/罗米司韦单抗的Fc段也经过了YTE改造。改造后,安巴韦单抗/罗米司韦单抗在人体内的半衰期延长到46-76天,是普通IgG抗体的2-3倍[22]。
这一改变也使得安巴韦单抗/罗米司韦单抗在靶器官肺部的浓度和暴露量显著提升,可长时间保持抗病毒活性,这在一定程度上也维持了它们对新冠病毒变异株的抵抗能力。由此可见,具有长效半衰期的安巴韦单抗/罗米司韦单抗,在治疗感染的同时,还有望给免疫功能低下的感染者提供长久的保护,在一定的时间内降低他们再次感染的风险。此外,长半衰期也为这一组合新冠暴露后和暴露前预防的临床研究(进行中)提供了基础。
和安巴韦单抗/罗米司韦单抗一样,Evusheld(Tixagevimab/Cilgavimab)这对中和抗体组合的Fc段也经过了YTE改造[23],改造后它们在人体内的半衰期长达90天左右[24]。
就在上个月20日,由Mark T. Esser领衔的研究团队,在《新英格兰医学杂志》上发表了中和抗体组合Tixagevimab/Cilgavimab用于新冠肺炎暴露前预防的详细临床数据[23]。
首先来看入组这个研究受试者的人口学特征[23]:他们的平均年龄为53.5岁,其中43.4%的受试者年龄在60岁或以上;入组时77.5%的受试者被认为感染新冠后有较高的重症风险。
结果显示,与安慰剂相比,随访6个月时,Tixagevimab/Cilgavimab组合使新冠有症状感染风险降低了82.8%[23]。这意味着,单次注射Tixagevimab/Cilgavimab组合可以给高风险群体提供至少6个月的免疫保护[23]。
正是基于以上数据,Tixagevimab/Cilgavimab已获得FDA和EMA批准,用于新冠肺炎暴露前预防[25,26]。适用人群为:由于医疗原因而导致免疫中度至重度受损,或因接受免疫抑制药物或治疗而无法对新冠疫苗产生足够免疫反应的人;以及由于对新冠疫苗和/或新冠疫苗成分有严重不良反应(如严重过敏反应)史,而不建议接种任何已批准或授权新冠疫苗的人[25]。
总的来说,抗新冠病毒中和抗体Fc段的YTE改造,大幅延长了中和抗体的半衰期,使它们具备了强效治疗和长期预防新冠感染的能力。
在未来,长效中和抗体会成为疫苗的有力补充,给不能接种疫苗或对疫苗响应较低的高危人群提供长久的免疫保护。